PROPIEDADES EXTENSIVAS E INTENSIVAS
La química actúa sobre la materia, que es todo aquello que nos rodea, ocupa un lugar y un espacio en el universo, y que somos capaces de identificar y conocer. La materia presenta dos tipos de propiedades: propiedades extensivas y propiedades intensivas.
Las propiedades extensivas se relacionan con la estructura química externa; es decir, aquellas que podemos medir con mayor facilidad y que dependen de la cantidad y forma de la materia. Por ejemplo: peso, volumen, longitud, energía potencial, calor, etcétera. Las propiedades intensivas, en cambio, tienen que ver más con la estructura química interna de la materia, como la temperatura, punto de fusión, punto de ebullición, calor específico o concentración , índice de refracción, entre otros aspectos.
Las propiedades intensivas pueden servir para identificar y caracterizar una sustancia pura, es decir, aquella que está compuesta por un solo tipo de molécula , como, por ejemplo, el agua, que está formada solo por moléculas de agua (H2O), o el azúcar, que solo la conforman moléculas de sacarosa (C12H22O11).
Las propiedades extensivas se relacionan con la estructura química externa; es decir, aquellas que podemos medir con mayor facilidad y que dependen de la cantidad y forma de la materia. Por ejemplo: peso, volumen, longitud, energía potencial, calor, etcétera. Las propiedades intensivas, en cambio, tienen que ver más con la estructura química interna de la materia, como la temperatura, punto de fusión, punto de ebullición, calor específico o concentración , índice de refracción, entre otros aspectos.
Las propiedades intensivas pueden servir para identificar y caracterizar una sustancia pura, es decir, aquella que está compuesta por un solo tipo de molécula , como, por ejemplo, el agua, que está formada solo por moléculas de agua (H2O), o el azúcar, que solo la conforman moléculas de sacarosa (C12H22O11).
PRINCIPIO DE ARQUÍMIDES
CONCEPTO
CONSISTE EN QUE CADA OBJETO QUE SE SUMERGE EN UN LÍQUIDO FLOTA O SE UNDE, ASÍ MISMO EL AGUA EJERCE UNA FUERZA DE EMPUJE QUE AUMENTA EL NIVEL DEL AGUA, SEGÚN EL VOLUMEN DEL OBJETO.
PRINCIPIO APLICADO CUANDO SE MIDE EL VOLUMEN DE UN OBJETO PEQUEÑO E IRREGULAR.( DALE UN CLICK A LOS LINKS O ENLACES SIGUIENTES):
ANTECEDENTES
VÍDEO SOBRE LOS ESTADOS DE LA MATERIA
CHAVOS DENLE UN CLIP AL ENLACE O LINK Y LOS LLEVARÁN A
LAS FASCINANTES CARACTERÍSTICAS DE LOS ESTADOS DE LA MATERIA, UN VÌDEO DE DISCOVERY CHANNEL. DISFRÚTENLO.
FUNCIÓN BIOLÓGICA DE LAS PROTEÍNAS
¿CUÁLES SON LAS FUNCIONES DE LAS PROTEÍNAS?
Las funciones de las proteínas son muy variadas:
Algunas proteínas transportan sustancias. La hemoglobina de los glóbulos rojos de los vertebrados lleva oxígeno desde los pulmones a todas las partes del organismo, mientras que en los invertebrados el transporte de oxígeno lo realiza otro tipo de proteínas, las hemocianinas.
Las proteínas también son necesarias para construir los tejidos y así formar los huesos, los tendones o la piel.
En los músculos hay dos proteínas, la actina y la miosina, que son indispensables para la contracción muscular.
Numerosas proteínas desempeñan funciones muy importantes para el organismo. Así, por ejemplo, muchas hormonas son proteínas y controlan diferentes procesos, como el crecimiento o la cantidad de glucosa en sangre; las enzimas son también proteínas y regulan la velocidad con que se producen las reacciones químicas en las células. Algunas proteínas participan en la coagulación de la sangre de los vertebrados; otras, como los anticuerpos, tienen una función de defensa muy importante y nos ayudan a luchar contra los microorganismos.
Las proteínas también pueden ser utilizadas como fuente de energía, aunque en menor proporción que los hidratos de carbono o las grasas.
Algunas proteínas tienen funciones poco habituales. ¿Sabes, por ejemplo, que los peces que viven en la Antártida a temperaturas por debajo de los 0ºC tienen una proteína que impide que su sangre se congele?
Las funciones de las proteínas son muy variadas:
Algunas proteínas transportan sustancias. La hemoglobina de los glóbulos rojos de los vertebrados lleva oxígeno desde los pulmones a todas las partes del organismo, mientras que en los invertebrados el transporte de oxígeno lo realiza otro tipo de proteínas, las hemocianinas.
Las proteínas también son necesarias para construir los tejidos y así formar los huesos, los tendones o la piel.
En los músculos hay dos proteínas, la actina y la miosina, que son indispensables para la contracción muscular.
Numerosas proteínas desempeñan funciones muy importantes para el organismo. Así, por ejemplo, muchas hormonas son proteínas y controlan diferentes procesos, como el crecimiento o la cantidad de glucosa en sangre; las enzimas son también proteínas y regulan la velocidad con que se producen las reacciones químicas en las células. Algunas proteínas participan en la coagulación de la sangre de los vertebrados; otras, como los anticuerpos, tienen una función de defensa muy importante y nos ayudan a luchar contra los microorganismos.
Las proteínas también pueden ser utilizadas como fuente de energía, aunque en menor proporción que los hidratos de carbono o las grasas.
Algunas proteínas tienen funciones poco habituales. ¿Sabes, por ejemplo, que los peces que viven en la Antártida a temperaturas por debajo de los 0ºC tienen una proteína que impide que su sangre se congele?
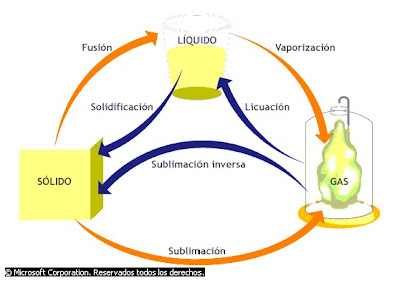
TIPOS DE CAMBIOS DE LA MATERIA
TIPOS DE CAMBIOS EN LA MATERIA
Según el tiempo que tarden en producirse los cambios, estos pueden ser:
rápidos: como la descomposición del cuerpo de un animal o la de cualquier otro ser vivo (descomposición de la materia orgánica);
lentos: como la erosión que sufre una roca por la acción del agua o del viento.
Además, los cambios en la materia pueden ser de estos dos tipos:
físicos, si tras el cambio la materia sigue siendo la misma; por ejemplo, tras un cambio de estado: el agua se congela transformándose en hielo o se evapora transformándose en vapor de agua, pero el agua líquida, el hielo y el vapor están constituidos por la misma materia;
químicos, si se transforma en otra materia diferente; por ejemplo, una combustión: la madera al arder se convierte en dióxido de carbono (y otros gases) y cenizas, que son sustancias diferentes a la inicial; se ha producido una reacción química. Una reacción química es el proceso por el que al poner en contacto dos o más sustancias, se transforman en otras sustancias diferentes a las iniciales.
CAMBIOS FÍSICOS
Algunos de ellos son:
Los cambios de estado, que son los pasos de sólido a líquido y a gas, o viceversa.
La dilatación, que es el aumento de volumen que se produce en un cuerpo a consecuencia del aumento de su temperatura.
El movimiento, o cambio de la posición que ocupa un cuerpo en el espacio.
La fragmentación, que es la división de un cuerpo en trozos más pequeños que conservan su misma naturaleza, como cuando partimos una barra de pan en trozos.
La mezcla de varias sustancias sólidas, líquidas o gaseosas, sin que ninguna de ellas pierda o cambie sus propiedades. Las mezclas son un cambio físico bastante frecuente, que vamos a estudiar más detenidamente.
Clases de mezclas y métodos de separación.
Hay dos tipos de mezclas:
homogéneas: si no podemos distinguir a simple vista sus componentes; por ejemplo, el aire que respiramos es una mezcla de gases: oxígeno, nitrógeno y, en menor proporción, dióxido de carbono, vapor de agua y otros; el agua de mar es una mezcla de agua y diferentes sales;
heterogéneas: si podemos distinguir sus componentes; por ejemplo, un vaso con agua y aceite: ambos se distinguen perfectamente; o una piedra de granito, en la que se aprecian sus tres componentes, cuarzo, feldespato y mica, al tener cada uno diferente color.
Hay seis métodos físicos principales para separar los componentes de una mezcla, eligiéndose uno u otro según que la mezcla sea sólida o líquida, y según las características de sus componentes:
Por tamización: si la mezcla está formada por granos de diferentes tamaños, haciéndola pasar por un tamiz, la separaremos en sus componentes. Los buscadores de oro usaban esta técnica para buscar las pepitas del mineral.
Por filtración: separamos un sólido del líquido en el que está suspendido, vertiendo la mezcla en un embudo con un filtro poroso por el que el líquido puede penetrar fácilmente. Así podemos separar arena y agua.
Por decantación: separamos dos líquidos de diferentes densidades, vertiendo la mezcla en un embudo de decantación; cuando ha reposado y se han formado dos capas, abrimos la llave inferior del embudo y dejamos caer el más denso, quedando el menos denso en el embudo. Así separamos una mezcla de aceite y agua, por ejemplo.
Por separación magnética: si una de las sustancias de la mezcla tiene propiedades magnéticas, como el hierro, la podemos separar con un imán.
Por evaporación: si en una mezcla líquida conseguimos que uno de los componentes se evapore, quedando el otro.
Por cristalización y precipitación: algunas mezclas líquidas, como la del sulfato de cobre en agua, tras calentarlas y filtrarlas, se dejan en un cristalizador (recipiente bajo y ancho), de manera que al enfriarse, el agua se evapora y el sulfato de cobre queda separado en forma de cristales.
CAMBIOS QUÍMICOS
Algunos de ellos son:
La oxidación, que es el cambio lento que sufren algunas sustancias en contacto con el oxígeno; por ejemplo, cuando partimos una manzana por la mitad y la dejamos en un plato, al cabo de uno o dos días vemos como la parte sin piel se ha oscurecido; o cualquier objeto de hierro, como una verja o una llave, que con el tiempo aparece recubierto de una capa de óxido de hierro.
La combustión, que es una oxidación con desprendimiento de calor.
La fermentación, que es la transformación que sufre el azúcar en alcohol y agua, por ejemplo el zumo de las uvas se convierte en vino.
La putrefacción, que es la descomposición de cualquier ser vivo tras su muerte.
Según el tiempo que tarden en producirse los cambios, estos pueden ser:
rápidos: como la descomposición del cuerpo de un animal o la de cualquier otro ser vivo (descomposición de la materia orgánica);
lentos: como la erosión que sufre una roca por la acción del agua o del viento.
Además, los cambios en la materia pueden ser de estos dos tipos:
físicos, si tras el cambio la materia sigue siendo la misma; por ejemplo, tras un cambio de estado: el agua se congela transformándose en hielo o se evapora transformándose en vapor de agua, pero el agua líquida, el hielo y el vapor están constituidos por la misma materia;
químicos, si se transforma en otra materia diferente; por ejemplo, una combustión: la madera al arder se convierte en dióxido de carbono (y otros gases) y cenizas, que son sustancias diferentes a la inicial; se ha producido una reacción química. Una reacción química es el proceso por el que al poner en contacto dos o más sustancias, se transforman en otras sustancias diferentes a las iniciales.
CAMBIOS FÍSICOS
Algunos de ellos son:
Los cambios de estado, que son los pasos de sólido a líquido y a gas, o viceversa.
La dilatación, que es el aumento de volumen que se produce en un cuerpo a consecuencia del aumento de su temperatura.
El movimiento, o cambio de la posición que ocupa un cuerpo en el espacio.
La fragmentación, que es la división de un cuerpo en trozos más pequeños que conservan su misma naturaleza, como cuando partimos una barra de pan en trozos.
La mezcla de varias sustancias sólidas, líquidas o gaseosas, sin que ninguna de ellas pierda o cambie sus propiedades. Las mezclas son un cambio físico bastante frecuente, que vamos a estudiar más detenidamente.
Clases de mezclas y métodos de separación.
Hay dos tipos de mezclas:
homogéneas: si no podemos distinguir a simple vista sus componentes; por ejemplo, el aire que respiramos es una mezcla de gases: oxígeno, nitrógeno y, en menor proporción, dióxido de carbono, vapor de agua y otros; el agua de mar es una mezcla de agua y diferentes sales;
heterogéneas: si podemos distinguir sus componentes; por ejemplo, un vaso con agua y aceite: ambos se distinguen perfectamente; o una piedra de granito, en la que se aprecian sus tres componentes, cuarzo, feldespato y mica, al tener cada uno diferente color.
Hay seis métodos físicos principales para separar los componentes de una mezcla, eligiéndose uno u otro según que la mezcla sea sólida o líquida, y según las características de sus componentes:
Por tamización: si la mezcla está formada por granos de diferentes tamaños, haciéndola pasar por un tamiz, la separaremos en sus componentes. Los buscadores de oro usaban esta técnica para buscar las pepitas del mineral.
Por filtración: separamos un sólido del líquido en el que está suspendido, vertiendo la mezcla en un embudo con un filtro poroso por el que el líquido puede penetrar fácilmente. Así podemos separar arena y agua.
Por decantación: separamos dos líquidos de diferentes densidades, vertiendo la mezcla en un embudo de decantación; cuando ha reposado y se han formado dos capas, abrimos la llave inferior del embudo y dejamos caer el más denso, quedando el menos denso en el embudo. Así separamos una mezcla de aceite y agua, por ejemplo.
Por separación magnética: si una de las sustancias de la mezcla tiene propiedades magnéticas, como el hierro, la podemos separar con un imán.
Por evaporación: si en una mezcla líquida conseguimos que uno de los componentes se evapore, quedando el otro.
Por cristalización y precipitación: algunas mezclas líquidas, como la del sulfato de cobre en agua, tras calentarlas y filtrarlas, se dejan en un cristalizador (recipiente bajo y ancho), de manera que al enfriarse, el agua se evapora y el sulfato de cobre queda separado en forma de cristales.
CAMBIOS QUÍMICOS
Algunos de ellos son:
La oxidación, que es el cambio lento que sufren algunas sustancias en contacto con el oxígeno; por ejemplo, cuando partimos una manzana por la mitad y la dejamos en un plato, al cabo de uno o dos días vemos como la parte sin piel se ha oscurecido; o cualquier objeto de hierro, como una verja o una llave, que con el tiempo aparece recubierto de una capa de óxido de hierro.
La combustión, que es una oxidación con desprendimiento de calor.
La fermentación, que es la transformación que sufre el azúcar en alcohol y agua, por ejemplo el zumo de las uvas se convierte en vino.
La putrefacción, que es la descomposición de cualquier ser vivo tras su muerte.
TIPOS DE PROTEÍNAS Y CÓDIGO GENÉTICO
LAS PROTEÍNAS SON ESENCIALES PARA LA CÉLULA.
Las proteínas son los compuestos orgánicos más abundantes en la célula, pues son los componentes bioquímicos que más participan en la estructura y función celular.
Hay muchas clases de proteínas y cada una con una función específica dentro de la célula; las enzimas y algunas hormonas son proteínas. Las membranas celulares y parte de los ribosomas, los cloroplastos, las mitocondrias, el citoplasma, están compuestos por este tipo de moléculas biológicas.
Al nivel de los organismos multicelulares, las proteínas forman parte de músculos, la sangre, el pelo, el tejido, los órganos del sostén, los fluidos corporales; que desempeñan diversidad de funciones pues actúan como catalizadores, moléculas estructurales, sistemas inmunológicos, reservas alimenticias y más.
La estructura y función están ligada a las proteínas; no puede haber vida sin ellas.
1.1.4 EL CÓDIGO GENÉTICO.
Un código genético es el conjunto de señales o mensajes enviados por el ADN, mediante procesos moleculares metódicos y sistemáticos que se traducen en caracteres de un Organismo (cabello negro, ojos cafés, piel blanca, alto, delgado, etc.).
Toda la información genética necesaria para formar un conejo, un árbol o un hombre con todas sus características fenotípicas y genotípicas, esta codificada en el ADN de los núcleos de las células germinales (óvulos y espermatozoides). Los patrones hereditarios (el lenguaje de la vida) que determinan todas las características de un organismo están compuestos por un lenguaje universal de cuatro letras: A, G, T y C, que son las iniciales de las cuatro bases nitrogenadas: adenina, guanina, timina y citosina; Que a su vez forman parte de los nucleótidos (unión de una base nitrogenada, un azúcar y un grupo de fósforo) que componen el ADN. La combinación y secuencia de estas letras conforma el código genético y decidirá las características fenotípicas.
El código genético está definido a partir de ARNm y, en lugar de timina se tiene uracilo en el anticodón. El código está conformado por tres nucleotidicas, que conforman el codón o unidad básica de la transmisión hereditaria. Nirenberg y Mathaey, identificaron un triplete artificial a base de ácido poliuridilico (UUU); este se adiciona a los ribosomas, estos producen polipéptidos que poseían fenilalanina, con lo que se dedujo que el triplete UUU es el que codifica a la fenilalanina.
-La traducción del mensaje se da a nivel del ribosoma, en presencia del ADN y se traduce cuando el ARN entra en relación con el ribosoma.
-El codón UUU del ARN es la trascripción de un codón AAA, proviene del ADN.
-Existen codones de iniciación para comenzar la lectura del mensaje y codones de terminación para finalizarlo.
-La mayoría de los 20 aminoácidos son especificados por más de un codón; solo la metionina y el triptófano son especificados por un solo codón.
-Es universal, pues se aplica a todo tipo de organismo, desde los virus hasta el hombre; el mismo codón traduce al mismo aminoácido en todos los organismos y los codones de inicio y terminación son los mismos.
-La mutación en un nucleótido afecta solo a un aminoácido.
-El orden de las bases es leída secuencialmente (no hay comas).
-Posee tripletes sin sentido que determinan la terminación de la cadena.
-No existe un triplete que codifique diferentes aminoácidos, pero si varios tripletes que codifiquen un aminoácido especifico.
Las proteínas son los compuestos orgánicos más abundantes en la célula, pues son los componentes bioquímicos que más participan en la estructura y función celular.
Hay muchas clases de proteínas y cada una con una función específica dentro de la célula; las enzimas y algunas hormonas son proteínas. Las membranas celulares y parte de los ribosomas, los cloroplastos, las mitocondrias, el citoplasma, están compuestos por este tipo de moléculas biológicas.
Al nivel de los organismos multicelulares, las proteínas forman parte de músculos, la sangre, el pelo, el tejido, los órganos del sostén, los fluidos corporales; que desempeñan diversidad de funciones pues actúan como catalizadores, moléculas estructurales, sistemas inmunológicos, reservas alimenticias y más.
La estructura y función están ligada a las proteínas; no puede haber vida sin ellas.
1.1.4 EL CÓDIGO GENÉTICO.
Un código genético es el conjunto de señales o mensajes enviados por el ADN, mediante procesos moleculares metódicos y sistemáticos que se traducen en caracteres de un Organismo (cabello negro, ojos cafés, piel blanca, alto, delgado, etc.).
Toda la información genética necesaria para formar un conejo, un árbol o un hombre con todas sus características fenotípicas y genotípicas, esta codificada en el ADN de los núcleos de las células germinales (óvulos y espermatozoides). Los patrones hereditarios (el lenguaje de la vida) que determinan todas las características de un organismo están compuestos por un lenguaje universal de cuatro letras: A, G, T y C, que son las iniciales de las cuatro bases nitrogenadas: adenina, guanina, timina y citosina; Que a su vez forman parte de los nucleótidos (unión de una base nitrogenada, un azúcar y un grupo de fósforo) que componen el ADN. La combinación y secuencia de estas letras conforma el código genético y decidirá las características fenotípicas.
El código genético está definido a partir de ARNm y, en lugar de timina se tiene uracilo en el anticodón. El código está conformado por tres nucleotidicas, que conforman el codón o unidad básica de la transmisión hereditaria. Nirenberg y Mathaey, identificaron un triplete artificial a base de ácido poliuridilico (UUU); este se adiciona a los ribosomas, estos producen polipéptidos que poseían fenilalanina, con lo que se dedujo que el triplete UUU es el que codifica a la fenilalanina.
-La traducción del mensaje se da a nivel del ribosoma, en presencia del ADN y se traduce cuando el ARN entra en relación con el ribosoma.
-El codón UUU del ARN es la trascripción de un codón AAA, proviene del ADN.
-Existen codones de iniciación para comenzar la lectura del mensaje y codones de terminación para finalizarlo.
-La mayoría de los 20 aminoácidos son especificados por más de un codón; solo la metionina y el triptófano son especificados por un solo codón.
-Es universal, pues se aplica a todo tipo de organismo, desde los virus hasta el hombre; el mismo codón traduce al mismo aminoácido en todos los organismos y los codones de inicio y terminación son los mismos.
-La mutación en un nucleótido afecta solo a un aminoácido.
-El orden de las bases es leída secuencialmente (no hay comas).
-Posee tripletes sin sentido que determinan la terminación de la cadena.
-No existe un triplete que codifique diferentes aminoácidos, pero si varios tripletes que codifiquen un aminoácido especifico.
PROPIEDADES FUNDAMENTALES DE LA MATERIA
MATERIA
Todo cuanto nos rodea en la naturaleza está constituido por materia, que es lo que forma los cuerpos. La materia se nos presenta en tres estados físicos, llamados estados de agregación: sólido, líquido y gaseoso.
PROPIEDADES FUNDAMENTALES DE LA MATERIA
La materia tiene propiedades que varían de unos cuerpos a otros. Aunque son muchas las que podemos estudiar: el color, el sabor, la dureza..., sabemos que no todas se dan en todas las sustancias; porque ¿qué dureza tienen los líquidos?, ¿a qué huele un trozo de hierro? o ¿qué sabor tiene el aire?
Por ello, nos fijamos en dos que sí tienen todos los cuerpos, llamadas propiedades fundamentales: el volumen y la masa.
El volumen de un cuerpo es el espacio que ocupa. Para medirlo utilizamos como unidad principal el metro cúbico (m3), que es el volumen que ocupa un cubo cuyo lado mide 1 metro. Aunque como esta unidad es bastante grande, con frecuencia usamos otras unidades más pequeñas, sus submúltiplos, en especial el decímetro cúbico (dm3) y el centímetro cúbico (cm3).
Utilizamos las unidades de volumen cuando tratamos con cuerpos sólidos, pero para los líquidos y gases solemos usar las unidades de capacidad, cuya unidad principal es el litro (l), y cuya equivalencia con la unidad principal de volumen es: 1 m3 = 1000 l
Podemos medir el volumen de un cuerpo de diferentes maneras:
Usando instrumentos de medida. Por ejemplo, con ayuda de una probeta u otro recipiente graduado podemos saber el volumen de un líquido. También podemos conocer el volumen de un cuerpo pequeño e irregular sumergiéndolo en un líquido y viendo la diferencia entre la altura del nivel del líquido después y antes de sumergirlo.
Efectuando cálculos matemáticos, si se trata de un sólido de forma sencilla, multiplicando el área de su base por su altura.
Como los gases ocupan todo el recipiente que los contiene, su volumen es el volumen del recipiente.
La masa es la cantidad de materia que tiene un cuerpo, y sus unidades principales son el kilogramo (kg), que coloquialmente llamamos kilo, y el gramo (g). Aunque midan igual, no debes confundir masa con peso de un cuerpo, ya que son conceptos físicos diferentes que mezclamos al hablar.
Mediante una balanza podemos medir la masa de cuerpos pequeños.
DENSIDAD
La relación entre la masa de un cuerpo y el volumen que ocupa recibe el nombre de densidad. Cada sustancia, en su estado natural, tiene una densidad característica. Por ejemplo, 1 litro de agua en estado líquido tiene una masa de 1 kilogramo: decimos que la densidad del agua es 1 kg/l. Y 1 litro de hierro, en estado sólido, tiene una masa de 7,9 kg: decimos que su densidad es de 7,9 kg/l.
Los cuerpos más densos que el agua, como una llave o un objeto de hierro, se hunden en ella; los menos densos, como un tapón de corcho o un trozo de madera, flotan sobre ella.
Si en un vaso echamos agua (densidad = 1 kg/l), aceite (densidad = 0,92 kg/l) y alcohol etílico (densidad = 0,8 kg/l), vemos cómo se forman tres capas de líquido: la de arriba de alcohol, la de en medio de aceite y la inferior de agua. Los tres líquidos se sitúan según el valor de sus densidades, sin mezclarse.
Para calcular la densidad de una sustancia hemos de medir primero su masa y su volumen. Su densidad será el resultado de dividir la masa entre el volumen hallado.
Para obtener la densidad de un sólido, lo podemos pesar en una balanza para saber su masa, y sumergirlo en un vaso con agua para calcular su volumen por diferencia entre los niveles del líquido.
Para medir la densidad de un líquido podemos utilizar un vaso graduado: primero hemos de pesar el vaso vacío y después lleno con el líquido, y restando obtenemos su masa. El volumen que ocupa lo vemos sobre la escala graduada. La densidad de un líquido también se puede medir directamente con un aparato llamado densímetro.
Para obtener la densidad de un gas utilizamos un recipiente cerrado de volumen conocido. Primero hemos de pesar el recipiente vacío, y luego lleno con el gas; restando obtenemos su masa. El volumen que ocupa es el del recipiente.
En la naturaleza, la materia se nos presenta en tres estados físicos diferentes: sólido, líquido y gaseoso. Aunque algunas sustancias, como el agua, pueden existir en los tres estados, lo normal es que, en su estado natural, cada sustancia aparezca en uno solo de ellos.
Por ejemplo, el hierro se encuentra en estado sólido (formando parte de distintos minerales), para pasarlo al estado líquido hay que fundirlo a temperaturas muy altas (en los altos hornos), y en el Sol, a millones de grados centígrados, está en estado gaseoso.
PROPIEDADES DE LOS SÓLIDOS
Las partículas que constituyen un sólido están unidas entre sí por fuerzas muy intensas, de manera que resulta muy difícil separarlas; por ello los sólidos tienen una forma bien definida.
Las partículas que constituyen un cuerpo sólido están tan próximas entre sí que por mucha fuerza que hagamos no las podemos acercar más; los sólidos son difíciles de comprimir, no cambian de volumen.
Algunas propiedades de los sólidos se deben precisamente a la forma y a la fuerza con que están unidas sus partículas. Estas propiedades son:
La dureza, o dificultad para rayar el cuerpo. Por ejemplo, el diamante es mucho más duro que un trozo de yeso.
La fragilidad, o tendencia de un sólido a romperse sin deformarse. Por ejemplo, el vidrio o el barro cocido son frágiles.
La ductilidad, o facilidad que ofrece un sólido a extenderse formando hilos. Por ejemplo, el cobre del que están hechos los hilos en el interior de los cables de la luz.
La maleabilidad, o capacidad que presenta un sólido para extenderse en forma de láminas. Por ejemplo, el oro y el aluminio son metales muy maleables.
La elasticidad, o tendencia de un sólido a recuperar su forma original tras ser sometido a una fuerza. Por ejemplo, una cinta de goma o un muelle son muy elásticos.
La flexibilidad, o facilidad de un sólido a doblarse sin romperse. Por ejemplo, podemos doblar una varita de mimbre o un folio de papel sin que se rompan.
La resistencia, o capacidad de un sólido para soportar pesos sin romperse. Por ejemplo, las casas se hacen con vigas de hierro o de hormigón, que soportan el peso de muros y techos.
PROPIEDADES DE LOS LÍQUIDOS
Los líquidos no tienen forma propia, sino que adoptan la forma del recipiente que los contiene.
Las partículas que constituyen los líquidos están más alejadas entre sí que en los sólidos, pero esta distancia no se puede hacer menor; por ello el volumen de un líquido no cambia, es decir, los líquidos tienen volumen constante.
Otras propiedades de los líquidos son la viscosidad y la volatilidad. Decimos que un líquido es viscoso cuando fluye muy lentamente, como la miel o el aceite, que son más viscosos que el agua.
Decimos que un líquido es volátil cuando se evapora con facilidad. El olor a gasolina en una gasolinera nos indica que se trata de un líquido volátil.
PROPIEDADES DE LOS GASES
Las partículas que forman los gases están unidas por fuerzas muy débiles. Debido a ello, los gases carecen de forma y volumen propios, adoptan la forma y tienden a ocupar todo el volumen del recipiente que los contiene.
Si al inflar un globo, no paramos de soplar, llegará un momento en que la presión sea tan grande que lo reviente, expandiéndose el aire de su interior.
Si con un dedo tapamos la boca de una jeringuilla y apretamos su émbolo, éste avanzará pues el aire que hay en su interior se comprime, mientras que si tiene agua, nos resultará imposible mover el émbolo, ya que los líquidos no se comprimen.
Los gases pueden pues comprimirse y expandirse (los líquidos y sólidos no). Comprimiendo o enfriando un gas, éste puede pasar al estado líquido, como sucede con el gas licuado que contienen las bombonas de butano.
Al estallar un castillo de fuegos artificiales, tiene lugar una transformación instantánea de la materia que forma los cohetes. De la misma forma, el agua de un río pule continuamente los cantos del fondo y de sus orillas, modificando su forma.
La materia que forma todos los cuerpos de la naturaleza no es inalterable, sino que cambia con el tiempo, aunque a veces no podamos apreciar los cambios que están sucediendo, hasta que no transcurre un largo periodo.
Todo cuanto nos rodea en la naturaleza está constituido por materia, que es lo que forma los cuerpos. La materia se nos presenta en tres estados físicos, llamados estados de agregación: sólido, líquido y gaseoso.
PROPIEDADES FUNDAMENTALES DE LA MATERIA
La materia tiene propiedades que varían de unos cuerpos a otros. Aunque son muchas las que podemos estudiar: el color, el sabor, la dureza..., sabemos que no todas se dan en todas las sustancias; porque ¿qué dureza tienen los líquidos?, ¿a qué huele un trozo de hierro? o ¿qué sabor tiene el aire?
Por ello, nos fijamos en dos que sí tienen todos los cuerpos, llamadas propiedades fundamentales: el volumen y la masa.
El volumen de un cuerpo es el espacio que ocupa. Para medirlo utilizamos como unidad principal el metro cúbico (m3), que es el volumen que ocupa un cubo cuyo lado mide 1 metro. Aunque como esta unidad es bastante grande, con frecuencia usamos otras unidades más pequeñas, sus submúltiplos, en especial el decímetro cúbico (dm3) y el centímetro cúbico (cm3).
Utilizamos las unidades de volumen cuando tratamos con cuerpos sólidos, pero para los líquidos y gases solemos usar las unidades de capacidad, cuya unidad principal es el litro (l), y cuya equivalencia con la unidad principal de volumen es: 1 m3 = 1000 l
Podemos medir el volumen de un cuerpo de diferentes maneras:
Usando instrumentos de medida. Por ejemplo, con ayuda de una probeta u otro recipiente graduado podemos saber el volumen de un líquido. También podemos conocer el volumen de un cuerpo pequeño e irregular sumergiéndolo en un líquido y viendo la diferencia entre la altura del nivel del líquido después y antes de sumergirlo.
Efectuando cálculos matemáticos, si se trata de un sólido de forma sencilla, multiplicando el área de su base por su altura.
Como los gases ocupan todo el recipiente que los contiene, su volumen es el volumen del recipiente.
La masa es la cantidad de materia que tiene un cuerpo, y sus unidades principales son el kilogramo (kg), que coloquialmente llamamos kilo, y el gramo (g). Aunque midan igual, no debes confundir masa con peso de un cuerpo, ya que son conceptos físicos diferentes que mezclamos al hablar.
Mediante una balanza podemos medir la masa de cuerpos pequeños.
DENSIDAD
La relación entre la masa de un cuerpo y el volumen que ocupa recibe el nombre de densidad. Cada sustancia, en su estado natural, tiene una densidad característica. Por ejemplo, 1 litro de agua en estado líquido tiene una masa de 1 kilogramo: decimos que la densidad del agua es 1 kg/l. Y 1 litro de hierro, en estado sólido, tiene una masa de 7,9 kg: decimos que su densidad es de 7,9 kg/l.
Los cuerpos más densos que el agua, como una llave o un objeto de hierro, se hunden en ella; los menos densos, como un tapón de corcho o un trozo de madera, flotan sobre ella.
Si en un vaso echamos agua (densidad = 1 kg/l), aceite (densidad = 0,92 kg/l) y alcohol etílico (densidad = 0,8 kg/l), vemos cómo se forman tres capas de líquido: la de arriba de alcohol, la de en medio de aceite y la inferior de agua. Los tres líquidos se sitúan según el valor de sus densidades, sin mezclarse.
Para calcular la densidad de una sustancia hemos de medir primero su masa y su volumen. Su densidad será el resultado de dividir la masa entre el volumen hallado.
Para obtener la densidad de un sólido, lo podemos pesar en una balanza para saber su masa, y sumergirlo en un vaso con agua para calcular su volumen por diferencia entre los niveles del líquido.
Para medir la densidad de un líquido podemos utilizar un vaso graduado: primero hemos de pesar el vaso vacío y después lleno con el líquido, y restando obtenemos su masa. El volumen que ocupa lo vemos sobre la escala graduada. La densidad de un líquido también se puede medir directamente con un aparato llamado densímetro.
Para obtener la densidad de un gas utilizamos un recipiente cerrado de volumen conocido. Primero hemos de pesar el recipiente vacío, y luego lleno con el gas; restando obtenemos su masa. El volumen que ocupa es el del recipiente.
En la naturaleza, la materia se nos presenta en tres estados físicos diferentes: sólido, líquido y gaseoso. Aunque algunas sustancias, como el agua, pueden existir en los tres estados, lo normal es que, en su estado natural, cada sustancia aparezca en uno solo de ellos.
Por ejemplo, el hierro se encuentra en estado sólido (formando parte de distintos minerales), para pasarlo al estado líquido hay que fundirlo a temperaturas muy altas (en los altos hornos), y en el Sol, a millones de grados centígrados, está en estado gaseoso.
PROPIEDADES DE LOS SÓLIDOS
Las partículas que constituyen un sólido están unidas entre sí por fuerzas muy intensas, de manera que resulta muy difícil separarlas; por ello los sólidos tienen una forma bien definida.
Las partículas que constituyen un cuerpo sólido están tan próximas entre sí que por mucha fuerza que hagamos no las podemos acercar más; los sólidos son difíciles de comprimir, no cambian de volumen.
Algunas propiedades de los sólidos se deben precisamente a la forma y a la fuerza con que están unidas sus partículas. Estas propiedades son:
La dureza, o dificultad para rayar el cuerpo. Por ejemplo, el diamante es mucho más duro que un trozo de yeso.
La fragilidad, o tendencia de un sólido a romperse sin deformarse. Por ejemplo, el vidrio o el barro cocido son frágiles.
La ductilidad, o facilidad que ofrece un sólido a extenderse formando hilos. Por ejemplo, el cobre del que están hechos los hilos en el interior de los cables de la luz.
La maleabilidad, o capacidad que presenta un sólido para extenderse en forma de láminas. Por ejemplo, el oro y el aluminio son metales muy maleables.
La elasticidad, o tendencia de un sólido a recuperar su forma original tras ser sometido a una fuerza. Por ejemplo, una cinta de goma o un muelle son muy elásticos.
La flexibilidad, o facilidad de un sólido a doblarse sin romperse. Por ejemplo, podemos doblar una varita de mimbre o un folio de papel sin que se rompan.
La resistencia, o capacidad de un sólido para soportar pesos sin romperse. Por ejemplo, las casas se hacen con vigas de hierro o de hormigón, que soportan el peso de muros y techos.
PROPIEDADES DE LOS LÍQUIDOS
Los líquidos no tienen forma propia, sino que adoptan la forma del recipiente que los contiene.
Las partículas que constituyen los líquidos están más alejadas entre sí que en los sólidos, pero esta distancia no se puede hacer menor; por ello el volumen de un líquido no cambia, es decir, los líquidos tienen volumen constante.
Otras propiedades de los líquidos son la viscosidad y la volatilidad. Decimos que un líquido es viscoso cuando fluye muy lentamente, como la miel o el aceite, que son más viscosos que el agua.
Decimos que un líquido es volátil cuando se evapora con facilidad. El olor a gasolina en una gasolinera nos indica que se trata de un líquido volátil.
PROPIEDADES DE LOS GASES
Las partículas que forman los gases están unidas por fuerzas muy débiles. Debido a ello, los gases carecen de forma y volumen propios, adoptan la forma y tienden a ocupar todo el volumen del recipiente que los contiene.
Si al inflar un globo, no paramos de soplar, llegará un momento en que la presión sea tan grande que lo reviente, expandiéndose el aire de su interior.
Si con un dedo tapamos la boca de una jeringuilla y apretamos su émbolo, éste avanzará pues el aire que hay en su interior se comprime, mientras que si tiene agua, nos resultará imposible mover el émbolo, ya que los líquidos no se comprimen.
Los gases pueden pues comprimirse y expandirse (los líquidos y sólidos no). Comprimiendo o enfriando un gas, éste puede pasar al estado líquido, como sucede con el gas licuado que contienen las bombonas de butano.
Al estallar un castillo de fuegos artificiales, tiene lugar una transformación instantánea de la materia que forma los cohetes. De la misma forma, el agua de un río pule continuamente los cantos del fondo y de sus orillas, modificando su forma.
La materia que forma todos los cuerpos de la naturaleza no es inalterable, sino que cambia con el tiempo, aunque a veces no podamos apreciar los cambios que están sucediendo, hasta que no transcurre un largo periodo.
Suscribirse a:
Comentarios (Atom)